Welttag des Reizdarmsyndroms
5. World IBS Day am 19. April 2024
Wir beantworten zum Welt-Reizdarmtag fünf eher ungewöhnliche Fragen, die aktuelle Aspekte in Pathogenese und Therapie aufzeigen.
Lassen Sie sich überraschen!

Falls Sie sich am 19. April wundern, warum berühmte Gebäude wie zum Beispiel der torre pendente di Pisa – also der schiefe Turm von Pisa – lilafarben angestrahlt sind:
Das ist ein Zeichen der Solidarität mit 10 Prozent der Weltbevölkerung. Denn so hoch ist der weltweite Anteil der Menschen mit Reizdarmsyndrom (worldibsday.org).
In Deutschland gelten 10 bis 15 Prozent der Bevölkerung als Reizdarmpatient:innen. Da die Diagnose auf dem Ausschluss anderer – zum Teil schwerwiegender – Erkrankungen beruht und die Symptome oft unspezifisch sind, ist die genaue Anzahl unbekannt. Der S3-RDS-Leitlinienautor Prof. Dr. A. Madisch warnte im Jahr 2022 (Gastroenterologie 2024): „Etwa drei Viertel der Betroffenen bekommen keine Behandlung, und die korrekte Diagnose wird entweder zu selten oder zu spät gestellt“.
Unter dem hashtag #WorldIBSDay2024 ist das Event in allen sozialen Medien zu finden.
FRAGE 1: Hat das Reizdarmsyndrom etwas mit der Darm-Hirnachse zu tun?
Ja. Das Reizdarmsyndrom gehört definitionsgemäß zu den neurogastroenterologischen Störungen der Darm-Gehirn-Interaktion.
Früher, als die wissenschaftlichen Erkenntnisse noch nicht so weit fortgeschritten waren, wurde es als funktionelle gastrointestinale Störung bezeichnet. Das sind gastrointestinale Syndrome, bei denen trotz umfangreicher Diagnostik keine objektiv messbaren Anomalien des Magen-Darm-Traktes festgestellt werden können.
Wie wir inzwischen wissen, gibt es aber durchaus enterale Anomalien beim Reizdarmsyndrom (siehe unten Frage 4). Zudem ist die Erkrankung „Reizdarmsyndrom“ nicht auf den Darm beschränkt, sondern bezieht auch die Darm-Hirn-Achse mit ein.
Beispielsweise werden im Darm von Reizdarmpatient:innen vermehrt schmerzleitende Nervenfasern aktiviert, deren Signale über die Darm-Hirnachse zum Gehirn gelangen und dort Schmerzen wahrnehmen lassen (Uranga JA et al. 2020).
Umgekehrt beeinflussen auch zentralnervöse Vorgänge über die Hirn-Darmachse das Reizdarmsyndrom: Beispielsweise wird unter Stress im Hypothalamus das Corticotropin-Releasing-Hormon CRH (auch als CRF = Corticotropin Releasing Factor bezeichnet) ausgeschüttet, das im Darm Mastzellen degranulieren lässt (Overman E et al. 2012, Hasler WL et al. 2022).
Wichtig: Mastzellen sind Schlüsselfaktoren im Reizdarmgeschehen (Uranga JA et al. 2020): Sie sind an der Schmerzentstehung sowie an Entzündungen beteiligt. Zudem halten Mastzellen das Leaky-Gut-Syndrom aufrecht, das ein Reizdarmsyndrom oft begleitet (Layer et al. 2021).
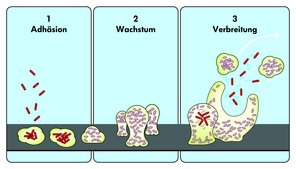
FRAGE 2: Reizdarm und Biofilme im Darm: Hängt das zusammen?
Ja – Biofilme im Darm und das Reizdarmsyndrom hängen zusammen.
Vorweg sei direkt gesagt: Ein gesundes Darmepithel ist nicht von stabilen Biofilmen bedeckt. Denn es erneuert sich alle 4 bis 5 Tage (Van der Flier & Clever 2009), wobei alte Epithelzellen abgestoßen werden. Deshalb ist eine stabile Biofilmbildung auf einem gesunden Darmepithel nicht zu erwarten, denn Biofilme können sich nur auf einer ruhigen, ungestörten Oberfläche etablieren.
Ein krankes Darmepithel kann sich jedoch meist nicht mehr regelmäßig abschilfern. Deshalb können sich darauf leichter Biofilme bilden.
Bei Untersuchungen an Reizdarmpatient:innen fanden Wissenschaftler:innen bei mehr als der Hälfte der Betroffenen gelbgrüne, klebrige Biofilme im Darm – trotz vorbereitender Darmreinigung. Dabei ist das Bakterium Ruminococcus gnavus häufig mit für die Biofilm-Überwucherungen verantwortlich (Baumgartner et al. 2021). Ruminococcus gnavus wirkt proinflammatorisch. Das Bakterium besiedelt den Darm von fast 90 Prozent aller Menschen, macht aber normalerweise weniger als 0,1 Prozent der Mikrobiota aus. Bei Morbus Crohn-Patient:innen fällt seine deutliche Vermehrung mit Krankheitsschüben zusammen (Henke et al. 2019).
In vielen Fällen können die hartnäckigen Biofilme im Dickdarm mit einer endoskopischen Spritzvorrichtung weggespült werden, was bei den Betroffenen zu einer deutlichen klinischen Verbesserung führt. Biofilme im Dünndarm, die auch häufig vorkommen, können damit allerdings noch nicht beseitigt werden. Weitere Forschungen dazu sind in Arbeit (Gasche 2023).

Publikation:
Das Reizdarmsyndrom:
Zusammenfassung aktueller Erkenntnisse und die Mikrobiom-basierte Therapie.
So geht es zum kostenfreien Download:

FRAGE 3: Gibt es Zusammenhänge zwischen COVID-19 und einer neu auftretenden Reizdarmerkrankung?
Wahrscheinlich ja. Denn das SARS-CoV-2 -Virus kann direkt den Intestinaltrakt infizieren (Settanie et al. 2021, Cheung et al. 2020). Wissenschaftler:innen fanden das Virus in Enterozyten und in Stuhlproben infizierter Patient:innen – sogar in Stuhlproben von Personen mit negativem Nasopharyngeal-Abstrich (Settanie et al. 2021).
Daher vermuten die Wissenschaftler:innen, dass durch die verschiedenen viral bedingten pathophysiologischen Veränderungen wie Dysbiose, Leaky Gut und niedriggradige mukosale Entzündung ein postinfektiöses Reizdarmsyndrom entstehen kann (Settanie et al. 2021).
FRAGE 4: Findet man Veränderungen im Darm von Reizdarmpatienten?
Ja und nein – je nach Art der durchgeführten Diagnostik.
Bei einer endoskopischen Untersuchung ist keine Veränderung sichtbar. In weitergehenden Untersuchungen wie histopathologischen Analysen und Stuhlanalysen fallen allerdings Veränderungen auf.
Dazu gehören:
- Dysbiose der Darmmikrobiota wie verminderte Zellzahlen von Faecalibacterium prausnitzii, Laktobazillen und Bifidobakterien (Chong et al. 2020).
- Auftreten von Biofilmen in Dünn- und Dickdarm (siehe Frage 2)
- Leaky-Gut-Syndrom (Layer et al. 2021), das sich diagnostisch durch Stuhl-Biomarker wie Zonulin und alpha-1 AT abklären lässt.
- Niedriggradige Entzündung als Folge der Störung des enteralen Immungleichgewichts (Layer et al. 2021). Reizdarmpatient:innen zeigen eine Erhöhung einzelner Zytokine oder eines Zytokinpanels (Layer et al. 2021).
Diagnostisch kann beispielsweise der sensitive Stuhl-Biomarker Lysozym eine niedriggradige Entzündung abklären. - Mastzellen: Reizdarmpatient:innen besitzen laut wissenschaftlicher Studien mehr Mastzellen, die dichter als normal zusammenliegen. Die Mastzellen sitzen dabei näher an den Nervenenden des enterischen Nervensystems als bei gesunden Menschen. Zudem degranulieren die Mastzellen von Menschen mit Reizdarmsyndrom leichter, setzen also ihre schmerz- und entzündungsfördernden Inhaltstoffe leichter frei. (Uranga JA et al. 2020, Singh et al. 2020).
Zur Schlüsselfunktion von Mastzellen siehe auch oben Frage 1.

FRAGE 5: Gibt es probiotische ARZNEIMITTEL, um das Reizdarmsyndrom mit spezifischen probiotischen Bakterien zu therapieren?
Ja, und zwar gibt es europaweit nur ein einziges probiotisches Arzneimittel mit lebenden Bakterien, das für die Behandlung aller Symptome des Reizdarms zugelassen ist: Symbioflor® 2 mit dem probiotischen Bakterienstamm Symbio E. coli DSM 17252.
Für Fachkreise sind nach Login in den Fachbereich hier detaillierte Fachinformationen und Produktmuster verfügbar. Ihre Patient:innen finden hier Informationen zum Produkt.
Wir gehen in den nächsten Monaten detailliert auf die Wirkmechanismen von Symbioflor® 2 gegen das Reizdarmsyndrom ein. Dazu zählt unter anderem die Stabilisierung der Darmbarriere (Anti-Leaky-Gut-Wirkung) und die Stabilisierung von Mastzellen.
Baumgartner M et al. Baumgartner Mucosal Biofilms Are an Endoscopic Feature of Irritable Bowel Syndrome and Ulcerative Colitis. Gastroenterology 2021:161:1245.
https://www.gastrojournal.org/article/S0016-5085(21)03138-3/fulltext
Cheung KS et al. Gastrointestinal manifestations of SARS-CoV-2 infection and virus load in fecal samples from a Hong Kong cohort: Systematic review and meta-analysis. Gastroenterology 2020;159:81–95.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7194936/
Chong PP et al. The Microbiome and Irritable Bowel Syndrome – A Review on the Pathophysiology, Current Research and Future Therapy. Front Microbiol 2019; 10: Artikel 1136.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6579922/
Gasche 2023. Bedeutung des Biofilms beim Reizdarmsyndroms. DGMIM Tagung 25.11.2023 Vortrag Prof. C. Gasche, Universitätsklinikum für Innere Medizin, Labor für Molekulare Gastroenterologie, Wien.
Hasler WL et al. Mast cell mediation of visceral sensation and permeability in irritable bowel syndrome. Neurogastroenterology & Motility 2022;34:e14339. https://pubmed.ncbi.nlm.nih.gov/35315179/
Henke RM et al. Ruminococcus gnavus, a member of the human gut microbiome associated with Crohn’s disease, produces an inflammatory polysaccharide. PNAS USA 2019;25:12672.
https://pubmed.ncbi.nlm.nih.gov/31182571/
Layer P, Andresen V et al. Update S3-Leitlinie Reizdarmsyndrom: Definition, Pathophysiologie, Diagnostik und Therapie des Reizdarmsyndroms der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). Juni 2021 – AWMF-Registriernummer: 021/016.
https://www.dgvs.de/wp-content/uploads/2021/07/Leitlinie-RDS_20210629_final.pdf
Overman E et al. CRF Induces Intestinal Epithelial Barrier Injury via the Release of Mast Cell Proteases and TNF- α. PLoS ONE 2021:7; e39935.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3386952/
Settanni CR et al. COVID-19 as a trigger of irritable bowel syndrome: A review of potential mechanisms. World J Gastroenterol 2021; 27(43): 7433-7445. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8613742/
Singh M et al. The relationship between mucosal inflammatory cells, specific symptoms, and psychological functioning in youth with irritable bowel syndrome. Sci Rep. 2020;10(1):11988.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7371888/
Uranga JA et al. Mast Cell Regulation and Irritable Bowel Syndrome: Effects of Food Components with Potential Nutraceutical Use. Molecules 2020;25:4314.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7570512/
Van der Flier L & H Clever. Stem Cells, Self-Renewal, and Differentiation in the Intestinal Epithelium. Annu Rev Physiol. 2009;71:241.
https://www.annualreviews.org/content/journals/10.1146/annurev.physiol.010908.163145
