CROSS-TALK per extrazelluläre Vesikel
Durchbruch in der Forschung zur Bakterien-Mensch-Kommunikation
Cross Talk – so lautet der Fachbegriff für die Kommunikation zwischen dem humanen Mikrobiom und uns – dem Menschen. Wir wissen schon lange, dass unsere Bakterien mit uns sprechen, und einige Kommunikationswege kennen wir bereits. Ein Beispiel dafür ist der Vagus-Nerv, der Signale von Darmbakterien zum Gehirn übermitteln kann.1
Nun klärten Wissenschaftler in Experimenten mit Mäusen einen weiteren Weg auf, der die Pharmakologie revolutionieren könnte: Darmbakterien verpacken ihre Stoffwechselprodukte in kleine Päckchen und schicken sie durch den Körper – sogar bis zum Gehirn.2 Damit gibt es den ersten direkten Beweis für den Transport funktionsfähiger Stoffwechselprodukte von Darmbakterien in individuelle Zellen verschiedener Gewebe und Organe.2
Genau genommen sind es keine Päckchen, sondern Membrankugeln. Die Bakterien schnüren sie sprichwörtlich aus ihrem eigenen Zellkörper ab und schicken sie - vermutlich über den Blutkreislauf - auf ihren Weg durch den Wirtsorganismus. Die kleinen Kugeln können alle bakteriellen Produkte enthalten, die sich im Zytoplasma einer Bakterienzelle befinden – beispielsweise Enzyme, weitere Proteine und RNA. Die Zielzellen des Körpers nehmen die Vesikel inklusive ihrer Fracht per Endozytose dann über ihre Zellmembran auf.
Genau genommen sind es keine Päckchen, sondern Membrankugeln. Die Bakterien schnüren sie sprichwörtlich aus ihrem eigenen Zellkörper ab und schicken sie - vermutlich über den Blutkreislauf - auf ihren Weg durch den Wirtsorganismus. Die kleinen Kugeln können alle bakteriellen Produkte enthalten, die sich im Zytoplasma einer Bakterienzelle befinden – beispielsweise Enzyme, weitere Proteine - auch Toxine - und RNA. Die Zielzellen des Körpers nehmen die Vesikel inklusive ihrer Fracht per Endozytose dann über ihre Zellmembran auf.
Darmbakterien ergänzen unser Metabolom
Unser Darm-Mikrobiom enthält 150-fach mehr Gene als wir Menschen in unserem Erbmaterial besitzen. Damit ergänzen unsere Darmbakterien das menschliche Metabolom – und beeinflussen mit ihren Stoffwechselprodukten auch die menschliche Gesundheit. Das betrifft beispielsweise metabolische Erkrankungen und die Gesundheit des intestinalen Epithels. Denn wie wir alle wissen: Die Wirkung der Darmbakterien geht weit über den Darm hinaus. Das spiegelt sich in Begriffen wie „Mikrobiota-Darm-Hirn-Achse“ (kurz: Darm-Hirn-Achse) oder „Mikrobiota-Darm-Leber-Achse“ wieder.
Und nun kennen wir einen weiteren bedeutsamen Weg, wie bakterielle Metaboliten gut geschützt an ihre Ziele im Säugetierorganismus gelangen.
Wissenschaftler bezeichnen die bakteriellen Transportkugeln als BEVs, also „bacterial-derived extracellular vesicles“, von Bakterien abstammende extrazelluläre Vesikel. Ihre Größe variiert, macht aber immer nur einen Bruchteil der Größe einer Bakterienzelle aus. Vermehren können sich die Vesikel nicht; diese Fähigkeit bleibt dem Eltern-Bakterium überlassen2.
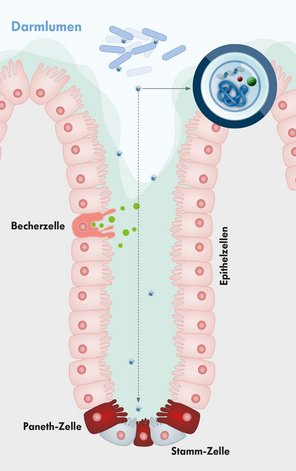
Vesikel gelangen sogar in die Tiefe der Krypten
Die Wissenschaftler nutzten ausgewählte E. coli-Bakterien, die im Darm der Mäuse Vesikel mit bestimmten Proteinen und RNA als detektierbare Fracht produzierten. Die Wissenschaftler fanden diese Fracht dann an unterschiedlichsten Körperstellen der Mäuse wieder, auch im Gehirn. Damit war bewiesen: Die Vesikel können epitheliale Barrieren überwinden – und sogar die hochselektive Blut-Hirn-Schranke.
Im Darm transportierten die Vesikel ihre bakterielle Fracht in intestinale Epithelzellen. Sie erreichten dabei alle Epithelzellen - von der Basis der bakterienfreien Krypten bis hoch zur Spitze der Villi, die in das Darmlumen hineinragen. Über die Vesikel gelangen die bakteriellen Stoffwechselprodukte sogar in die intestinalen Stammzellen, die tief unten in den Krypten für die Produktion neuer intestinaler Epithelzellen sorgen.
Weiterhin erreichten die bakteriellen Vesikel die Lamina propria. Hier befinden sich viele Immunzellen und das größte Makrophagen-Reservoir des Körpers. Wie die Wissenschaftler zeigten, nahmen auch Makrophagen der Lamina propria die Vesikel-Fracht der E. coli-Darmbakterien auf.
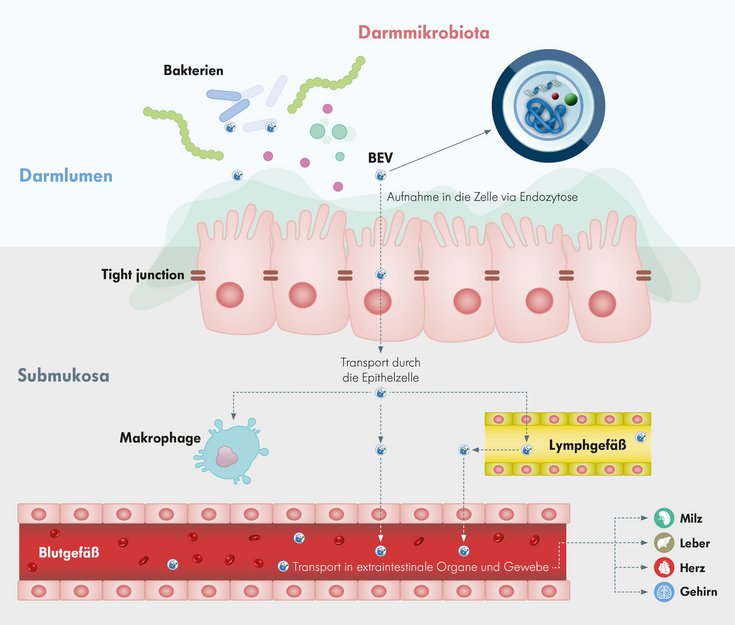
Vesikel-Ziele außerhalb der Darmmukosa
Im nächsten Schritt überprüften die Wissenschaftler, ob die bakteriellen Vesikel auch Makrophagen außerhalb der Darmmukosa erreichen: Sie fanden die Fracht der von Darmbakterien stammenden Vesikel auch in peritonealen Makrophagen.
BEVs – bakterielle Vesikel – können also nicht nur die intestinale Muzinschicht bis zum Darmepithel durchdringen, sondern durchwandern die epitheliale Barriere und transportieren bakterielle Produkte in das darunterliegende Immunsystem bis hin zum Peritoneum.
In weiteren Schritten untersuchten die Wissenschaftler Milz, Herz, Leber und Gehirn der Mäuse. Wie die Studienergebnisse zeigten, hatten die Vesikel alle genannten Organe erreicht und ihre bakteriellen Stoffwechselprodukte dort an individuelle Zellen übergeben2.

Grundlage für innovative Pharmakotherapie
Die Erkenntnisse könnten für neue Therapieformen genutzt werden.
Weitere Studien werden folgen, um die Ergebnisse am Menschen zu bestätigen. Darüber hinaus sehen die Wissenschaftler weitere Potentiale: Die neu etablierte Forschungsmethode wird helfen, den Einfluss von Darmbakterien auf Krankheiten besser zu verstehen. Zudem, so die Wissenschaftler, lassen sich auf ihrer Grundlage voraussichtlich innovative Verabreichungsformen von Medikamenten oder Impfstoffen entwickeln2. Wir sind gespannt!
Zusammenfassung:
Intestinale BEVs - von Darmbakterien abgeschnürte Vesikel – können bioaktive bakterielle Substanzen durch diverse Barrieren transportieren.
Die BEVs durchqueren dabei unter anderem die Darmbarriere und die Blut-Hirn-Schranke und gelangen so zu peripheren Organen bis hin zu Neuronen des Gehirns.
Damit liegt anhand von Tierstudien der erste direkte Beweis für den Transport bioaktiver bakterieller Produkte von Darmbakterien in verschiedenste Körpergewebe und Organe vor.
1. Bravo JA et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. PNAS 2011;108: 16050.
2. Bittel M et al. Visualizing transfer of microbial biomolecules by outer membrane vesicles in microbe-host-communication in vivo. J Extracell Vesicles 2021;10: e12159.